Строение белков
Белки (протеины) составляют 50% от сухой массы живых организмов.
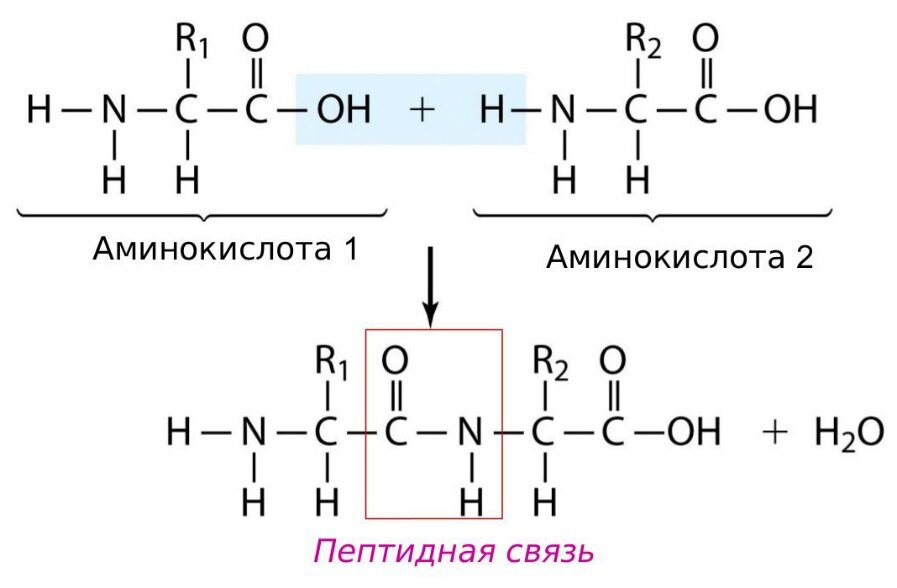
Белки состоят из аминокислот. У каждой аминокислоты есть
- радикал (по ним аминокислоты отличаются друг от друга)
- аминогруппа и кислотная (карбоксильная) группа, при взаимодействии которых получается пептидная связь, поэтому белки еще называют полипептидами.
Рисунок «Аминокислоты и пептидная связь»
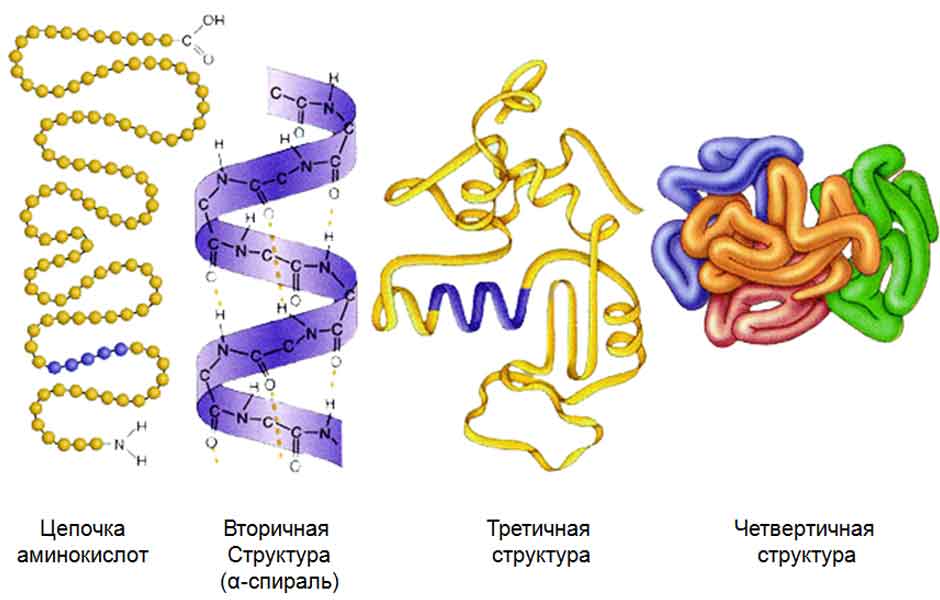
Структуры белка
Первичная структура – цепочка из аминокислот, связанных пептидной связью (сильной, ковалентной). Чередуя 20 аминокислот в разном порядке, можно получать миллионы разных белков. Если поменять в цепочке хотя бы одну аминокислоту, строение и функции белка изменятся (генная мутация, например, СКА). Поэтому первичная структура считается самой главной в белке.
Вторичная структура – спираль (альфа-спираль). Второй (реже встречающийся) вариант вторичной структуры белка – бета-слой. Вторичная структура удерживается (слабыми) водородными связями между пептидными группами.
Третичная структура – глобула (шарик). Второй (реже встречающийся) вариант третичной структуры – фибрилла (волокно, нить). Третичная структура удерживается четырьмя типами связей:
- дисульфидная (серный мостик) сильная,
- остальные три (ионные, гидрофобные, водородные между радикалами аминокислот) – слабые.
Форма глобулы у каждого белка своя, от нее зависят функции. При денатурации форма глобулы меняется, и это сказывается на работе белка. Примеры фибриллярных белков – кератин, коллаген.
Четвертичная структура – имеется не у всех белков. Состоит из нескольких глобул, соединенных между собой теми же связями, что и в третичной структуре. (Например, гемоглобин.)
Рисунок «Структуры белка»
© Д.В.Поздняков, 2009-2020